







ホーム > 新着情報:プレスリリース > 2021年06月 > 学長定例記者会見を開催しました(6/3) > アルツハイマー病の原因物質の新しい毒性制御メカニズムを発見 ~「出入り」による抑制メカニズムと促進メカニズムのせめぎあい~
掲載日:2021.06.03

認知症疾患の中で最も患者数の多いアルツハイマー病では、脳内で生成されるアミロイドβ蛋白質の凝集化が毒性や発症に関係していると考えられています。通常、脳内で生成されたアミロイドβ蛋白質は脳脊髄液の流れにより脳外へ洗い流され、脳内での凝集化・毒性化を抑制するメカニズムが働いています。しかし、山形大学の並河英紀教授の研究グループらは、この脳脊髄液による流れが、逆に、凝集化・毒性化を促進させるメカニズムも有する可能性があることを突き止めました。この発見に至った鍵となるポイントは、これまで世界中で行われてきた試験管やシャーレなど外部との物質のやり取りのない(出入りのない=閉鎖系)条件での実験結果と、脳内と同様に物質のやり取りがある(出入りがある=開放系)条件での実験結果を比較したことです。
本結果は、通常考えられてきた抑制メカニズムとは相反するものであり、実際の脳内では、抑制メカニズムと促進メカニズムがせめぎあっていることを示唆しています。本研究は生体内での実験ではないため実際の脳内での現象に直結しているかどうかの確証はないですが、本成果を応用することで、パーキンソン病やプリオン病など、アルツハイマー病と同様に蛋白質凝集が引き起こす病気の発症機構の理解につながることが期待できます。
本成果は2021年5月13日付でアメリカ化学会の物理科学専門誌「The Journal of Physical Chemistry Letters」に掲載されるとともに、掲載号の表紙(Front Cover)を飾ることになりました。
詳しくはこちら(プレスリリース)をご覧ください。
日本での認知症患者数は予備軍も含め1000万人にも上ると言われています。その中で最も多いアルツハイマー病は、その原因物質であるアミロイドβ蛋白質の神経細胞上での凝集化が関与していると考えられています。しかしながら、その発症機構は複雑であり、発症後の進行を遅らせることはできても治すことができない病気であると知られています(注1)。アミロイドβ蛋白質は脳内で作られていますが、脳脊髄液とよばれる液体が循環し、アミロイドβ蛋白質を脳外へと洗い流しています。これによって、通常は脳内にアミロイドβ蛋白質が溜まることなく発病することを抑制していると考えられています。
これまで、アミロイドβ蛋白質と神経細胞膜との相互作用についての研究は世界中で行われてきましたが、その多くは、試験管やシャーレなど、「中と外との間の物質の出入り」を無視した閉鎖系空間で行われてきました。一方、上で述べた脳脊髄液による洗い流しは、アミロイドβが脳内で生成し・運ばれ・脳外へ排斥されるという「中と外の間の物質の出入り」がある開放系空間であることを示します。試験管やシャーレの様に「出入りが無い閉鎖系空間」と、脳のような「出入りがある開放系空間」では、同じ分子でも異なった化学反応・構造変化を示すことがあります。生体内の反応は開放系で進行しているにもかかわらず、多くの実験が閉鎖系で行われているため、その本質を見誤っている可能性があるのです。
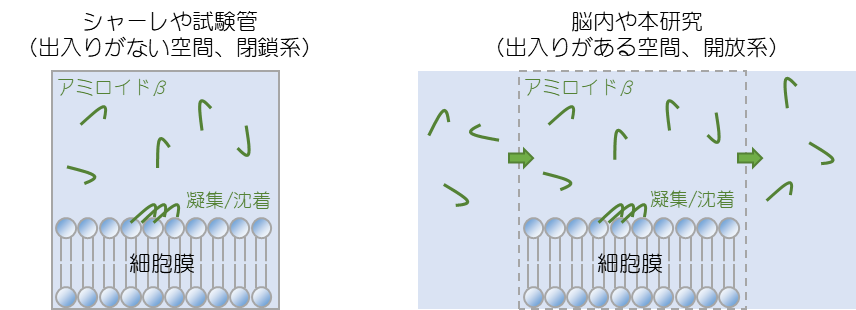
そこで本研究では、マイクロ流路(※2)を用いてアミロイドβ蛋白質の「出入りがある開放系空間」を作り、その空間でのアミロイドβ蛋白質の凝集挙動を観察しました。その結果、出入りが無い閉鎖系条件よりも、実際の脳内と同様に出入りがある開放系条件の方が凝集化を顕著に促進することを発見しました。従来の考え方では脳脊髄液の出入りが凝集化・毒性化を抑制しているものと考えられてきましたが、本研究により、条件によっては促進する可能性があることも示唆されました。

脳脊髄液の出入り(=流れる速度)は年齢・疾病により変動することが知られています。今後、様々な条件での研究を行うことで、アミロイドβ蛋白質の凝集化・毒性化に対する抑制効果と促進効果に対して更に詳しい検証を行う予定です。現時点では人工的なモデル細胞膜(※3)や人工的な脳脊髄液を用いた実験であるため、本結果が実際の脳内での現象に直結しているかどうかの確証はないですが、本研究で得られた知見は、アルツハイマー病および類似疾患の発症・進行メカニズムの研究において、脳内の開放系条件を考慮する必要性を提案し新しい研究戦略・研究指針を提案するものであります。
1.アミロイドβ蛋白質:分子量が約4,500の蛋白質。分子同士が集まって凝集体を形成し、それが神経細胞に沈着(くっつく)ことで神経毒性をもたらし、アルツハイマー病を引き起こすと考えられている。
2.マイクロ流路:深さ・幅がマイクロメートルスケールの流路が集まって作られたもの。微小量の試料で実験ができるため、生体分子など少量しか得られない物質を用いた実験などに用いられる。
3.モデル細胞膜:実際の細胞膜は様々な分子を含む混合物ですが、その中の特定の分子のみを使って人工的に作られた細胞膜。
注1:「アデュカヌマブ」が承認されれば、アルツハイマー病の世界初の治療薬となる。(2020年12月10日、エーザイ株式会社のニュースリリース参照)
雑誌名:The Journal of Physical Chemistry Letters
著者名:飯田茜 1, 安部光洋 1, 野地美緒音 2, 曽我千秋 2, 鵜浦啓 2, 並河英紀 2.
題名:Promoted Aggregation of Aβ on Lipid Bilayers in an Open Flowing System
所属:1. 山形大学大学院理工学研究科 2. 山形大学理学部
本研究は、以下のJSPS科研費(いずれも研究代表者:並河英紀)の一環として行われました。
19H02668 基盤研究(B) 生命システムを支える非平衡自己組織化プログラムの機構と機能
18K19051 挑戦的研究(萌芽) メカノモレキュラーサイエンスの開拓:流動作用のシステム論構築
16H04092 基盤研究(B) 非平衡空間がもたらす生体内二次元界面の構造と機能