







ホーム > 新着情報:プレスリリース > 2023年12月 > 細胞小器官の膜を溶解する酵素の活性化機構を解明
掲載日:2023.12.20
発表のポイント
◆リン脂質分解酵素Atg15が細胞小器官の膜を直接溶解することを明らかにしました。
◆Atg15がタンパク質分解酵素により部分切断を受けて活性化する分子機構を解明しました。
◆特定の細胞小器官の分解、エンベロープウイルス(新型コロナウイルスやインフルエンザウイルス)の不活化などへの応用が期待されます。
詳しくは、こちら(プレスリリース資料)をご覧ください。
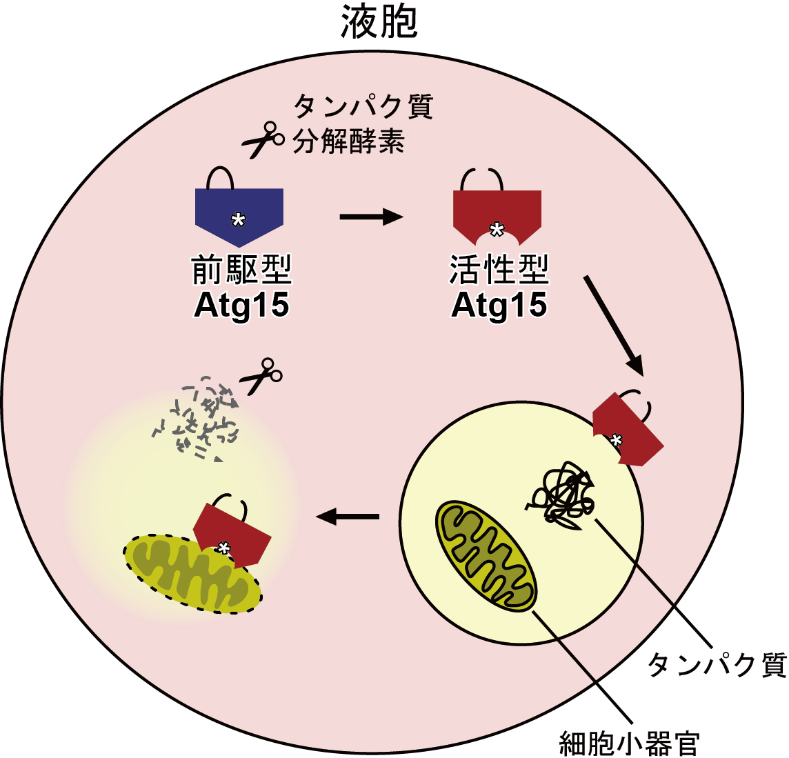
▲Atg15が液胞内部で細胞小器官を分解する機構の模式図
発表概要
東京大学大学院新領域創成科学研究科の佐々木 杏佳技術員、鈴木 邦律准教授、山形大学学術研究院(理学部主担当)の渡邊 康紀准教授、同大学理学部の岩﨑 佑里菜学部生(研究当時)、産業技術総合研究所細胞分子工学研究部門の本野 千恵主任研究員、今井 賢一郎研究グループ長らによる研究グループは、リン脂質(注1)を分解する酵素Atg15リパーゼ(注2)の活性化機構を明らかにしました。
ヒトを含む真核生物は、細胞内部にリン脂質からなる生体膜で区切られた細胞小器官(注3)を持ちます。古くなった細胞小器官はオートファジー(注4)と呼ばれる細胞内分解システムにより、液胞に輸送されたのち分解されますが、そのためには、まず細胞小器官を包んでいる生体膜を分解しなければなりません。
これまでの研究で、Atg15を持たない細胞において液胞内に未消化の細胞小器官が蓄積することが知られていましたが、Atg15が直接生体膜を分解する活性を有するかどうかは明らかになっていませんでした。
今回、Atg15の組換えタンパク質(注5)を大量精製することに成功しました。そして、精製されたAtg15はリン脂質を分解する活性を持つことを確認しました。さらに、タンパク質分解酵素で処理するとAtg15の活性が増強し、細胞小器官を包むリン脂質膜を分解できるようになることを発見しました。
これまでに知られているリン脂質分解酵素は対象となるリン脂質を無差別に分解するものしか知られていませんでした。Atg15は特定の条件で細胞内小器官を分解する活性を発揮する点で新規の活性を有する酵素であり、反応条件を制御することで、特定の細胞小器官の分解や、新型コロナウイルスやインフルエンザウイルスのようなエンベロープウイルス(注6)の不活化などへの応用が期待されます。
本研究成果は2023年12月19日付けで、国際科学誌『Cell Reports』にオンライン掲載されます。
発表内容
〈研究の背景〉
出芽酵母Saccharomyces cerevisiae(いわゆるパン酵母)は単細胞の真核生物であり、基礎研究に広く利用されています。ヒトを含む真核生物は、細胞内部にリン脂質からなる生体膜で区切られた細胞小器官を持ちます。古くなった細胞小器官はオートファジーと呼ばれる細胞内分解システムにより、分解を担う細胞小器官である液胞に輸送されたのち分解されます。細胞小器官の内容物を分解するためには、まず細胞小器官を包んでいる生体膜を分解しなければなりません。これまでの研究で、Atg15を持たない細胞では液胞内に未消化の細胞小器官が蓄積することが知られていましたが、Atg15変異体以外にも未消化の細胞小器官が蓄積する変異体があったので、Atg15が直接生体膜を分解する活性を有するかどうかは明らかになっていませんでした。これまで、精製Atg15を使用して活性測定をする研究は報告されたことがなかったので、我々はAtg15の精製と活性測定を目標に研究を進めました。
〈研究の内容〉
今回、好熱性糸状菌Chaetomium thermophilum(注7)のAtg15を組換えタンパク質として大腸菌から大量精製することに成功しました(以後「組換えAtg15」と呼びます)。研究を進めた結果、組換えAtg15が細胞小器官を包んでいる生体膜を分解する活性を持つことが初めて確認されました。
さらに、組換えAtg15をプロテアーゼKというタンパク質分解酵素を用いて処理することで、Atg15の酵素活性が劇的に上昇することが分かりました。プロテアーゼKによって組換えAtg15を構成するポリペプチド鎖の1か所が切断されたAtg15は2つのポリペプチド鎖(注8)に分割されましたが、この2つのポリペプチド鎖は分離することなくひとつの酵素としてふるまうことが分かりました(以後「活性型Atg15」と呼びます)。また、Atg15の酵素活性は酸性条件でのみ検出され、中性もしくは塩基性条件では検出されなかったことから、Atg15の活性化にはプロテアーゼによる切断と酸性条件という少なくとも2つの条件が必要なことが分かりました。出芽酵母ではこの2つの条件を満たすのは液胞の内部のみなので、Atg15は液胞の内部でのみ活性を持っていると考えられます。
そこで我々は深層学習を利用したタンパク質の立体構造を予測するソフトウェアAlphaFold2を使用して予測された前駆型(注9)Atg15と活性型Atg15の構造を用いて、分子動力学シミュレーション解析(注10)を行いました(図1)。
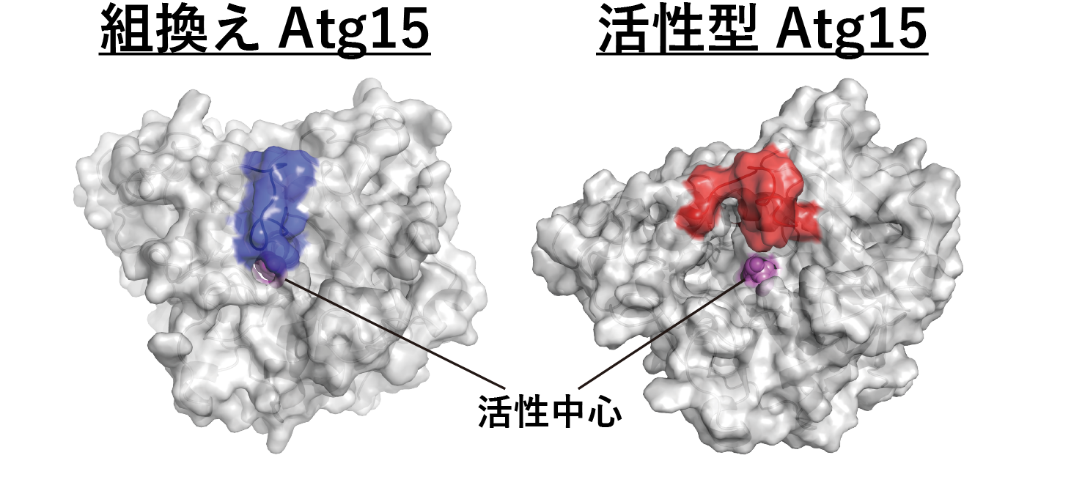
▲図1:分子動力学シミュレーション解析で得られた組換えAtg15と活性型Atg15の構造
組換えAtg15(前駆型)では活性中心が青の領域で覆われているが、活性型のAtg15ではその領域が赤の領域に移動することで活性中心が露出する。
前駆型Atg15は活性中心(注11)が構造内部に埋もれたまま変化がほとんど見られませんでした。これは標的となるリン脂質がAtg15の活性中心に結合できず分解されないことを意味しています。それに対して、活性型Atg15では活性中心付近の構造が柔軟に変化し、活性中心が外部に露出する様子が観測されました。この状態であれば、基質となるリン脂質と結合し分解を行うことができると考えられます。Atg15分子自体の柔軟性を向上させ、活性中心を露出可能にすることがプロテアーゼKによるAtg15活性化の分子機構の本質であると考えられます。
次に我々は、組換えAtg15が細胞内から取り出した細胞小器官を分解できるかどうかを確認しました。Saccharomyces cerevisiaeの細胞からミトコンドリア(注12)を取り出し、活性型Atg15と反応させたところ、ミトコンドリア膜が溶解し、ミトコンドリア内部のタンパク質が外部に漏出することが実験的に示されました。また、ミトコンドリア以外の細胞小器官の溶解も観察されたことから、Atg15が広く細胞小器官の膜を溶解する活性を有することが明らかとなりました。
活性型のAtg15は液胞とよばれる細胞小器官に内包されていますが、生きた細胞内では液胞膜がAtg15により分解されることはありません。現在、この疑問を解決すべく研究を進めています。
本研究において、東京大学では細胞から取り出した細胞小器官を用いてのAtg15リパーゼの活性測定、山形大学ではAtg15リパーゼの構造生物学的な解析および人工基質を用いた活性測定、産業技術総合研究所ではAtg15リパーゼの分子動力学シミュレーションによる機能解析を行いました。
発表者
東京大学大学院新領域創成科学研究科 鈴木 邦律 准教授 佐々木 杏佳 技術員
山形大学 学術研究院(理学部主担当)渡邊 康紀 准教授 理学部 岩﨑 佑里菜 研究当時:学部生
産業技術総合研究所細胞分子工学研究部門 今井 賢一郎 研究グループ長 本野 千恵 主任研究員
論文情報
〈雑誌〉Cell Reports
〈題名〉Atg15 is a vacuolar phospholipase that disintegrates organelle membranes
〈著者〉Yasunori Watanabe*, Yurina Iwasaki, Kyoka Sasaki, Chie Motono, Kenichiro Imai and Kuninori Suzuki*
*共同責任著者
〈DOI〉 10.1016/j.celrep.2023.113567
〈URL〉 https://doi.org/10.1016/j.celrep.2023.113567
日本時間12月20日午前1時(米国東部時間:19日午前11時)以前の公表は禁じられています。
本研究は科学技術振興機構(JST)戦略的創造研究推進事業 CREST 研究領域「細胞内現象の時空間ダイナミクス(課題番号JPMJCR20E3)」ならびに日本学術振興会 科学研究費助成事業(23K11313、22K0609、22H02569、21K19205、21H03551、20H05313)の一環として行われました。また本研究は内藤記念科学振興財団および日本医療研究開発機構(AMED)創薬等先端技術支援基盤プラットフォーム(BINDS)(課題番号23ama121029j0002)の支援を受け行われました。
(注1)リン脂質:グリセリンの3つの水酸基に2つの脂肪酸鎖とリン酸を含む極性基が結合した脂質。生体膜を構成する主成分である。
(注2)リパーゼ:脂質のエステル結合を加水分解する酵素の総称。一般的にはグリセリンと脂肪酸が結合したトリグリセリドを分解する酵素を指すことが多いが、ここでは生体膜の主成分であるリン脂質を加水分解する酵素を指す。
(注3)細胞小器官:生体膜で区切られた、細胞内で特定の機能を担う区画。細胞核・ミトコンドリア・小胞体・ゴルジ体・液胞(リソソーム)などが知られている。
(注4)オートファジー:細胞質や異常な細胞小器官(異常ミトコンドリアなど)を生体膜に包み込んだのち液胞(リソソーム)に送り込むことで分解・再利用するしくみ。
(注5) 組換えタンパク質:目的のタンパク質の遺伝子を、遺伝子組換え技術を使って大腸菌などの微生物に導入して合成させたタンパク質のこと。
(注6) エンベロープウイルス:細胞小器官と同様にリン脂質からなる膜で包まれているウイルスの総称。新型コロナウイルスやインフルエンザウイルスはエンベロープウイルスである。
(注7) 好熱性糸状菌Chaetomium thermophilum:耐熱性の高いカビの一種。60℃の高温環境下でも生育できる。一般に耐熱性の高い生物が持つタンパク質は安定であり、実験に使いやすいことが多い。
(注8) ポリペプチド鎖:複数のアミノ酸がペプチド結合を形成することで長く連なったもの。タンパク質は、ポリペプチド鎖が折りたたまれることで立体的な構造を取り、機能を発揮する。
(注9) 前駆型:活性のない状態で合成され、その後一部が切断もしくは構造が変化することで活性を示すようになる酵素について、切断もしくは構造が変化する前の状態のこと。
(注10)分子動力学シミュレーション解析:タンパク質などの分子をコンピュータ上に再現し、構成する原子間および溶媒中に含まれる分子との間に働く力を用いて運動方程式を解き、分子の経時的な構造変化を追跡する解析手法。
(注11)活性中心:基質が結合して触媒反応が起こる酵素の部位。
(注12)ミトコンドリア:酸素を消費してエネルギー生産を行う細胞小器官。細胞内のエネルギー工場とも呼ばれる。