







ホーム > 新着情報:プレスリリース > 2021年01月 > 細胞内の脂質交通を追跡できる実験手法を開発~ミトコンドリア内膜における脂質のフロップを計測することに成功~
掲載日:2021.01.15
私たちの体を構成する細胞はリン脂質を主成分とする「脂質膜」で形成されています。しかし脂質膜の主成分であるリン脂質が,異なる脂質膜間をどのように移動されているのかについては不明な点が多く残されています。山形大学の田村康教授(分子細胞生物学)の研究グループは,細胞内にある脂質輸送経路を明らかにするために,大腸菌のホスファチジルセリン(PS)合成酵素を,真核生物である出芽酵母細胞内の様々なオルガネラ膜区画に移植することを着想しました。PSはミトコンドリアに移動するとホスファチジルエタノールアミン(PE)と呼ばれる異なるリン脂質に変換される性質があります。この性質を利用して,細胞内の様々なオルガネラ膜上で合成されたPSが,ミトコンドリアに輸送されうるかを,PS→PEの変換をモニターすることで検出することに成功しました。この実験系が確立したことで,これまで生きた細胞で計測することが難しかったミトコンドリア内膜におけるリン脂質のフロップを簡便に計測できるようになりました。また,ペルオキシソームや脂肪滴といったオルガネラ膜からミトコンドリアへ効率よく脂質が移動する経路があることが示唆されました。細胞内の脂質輸送は生物が生きる上で必須の現象であり,その破綻は脂質代謝異常を原因とした疾患を引き起こすと考えられます。本研究成果を応用することで,今後細胞内脂質代謝異常によって引き起こされる疾患の病態解明や治療法開発に役立つことが期待されます。
本研究の成果は2020年12月7日に科学誌FEBS Journalにオンライン掲載されました。
詳しくはこちら(プレスリリース)をご覧ください
【背景】
私たちの体を構成する細胞や,細胞内に発達した,核,ミトコンドリア,小胞体といったオルガネラは,すべて脂質膜(脂質二重層:図1)で構成されています。細胞やオルガネラがその特徴的な構造や機能を維持するためには,個々の脂質膜が,適切な脂質組成を保たなければなりません。しかし,脂質膜の主成分であるリン脂質がその合成後,様々な脂質膜へとどのような輸送経路で分配されるのか,といった基本的なことすら不明な点が多く残されています。
【研究手法・研究成果】
田村教授らの研究グループでは,細胞内にある脂質輸送経路を明らかにするために,大腸菌のホスファチジルセリン(PS)合成酵素を,真核生物である出芽酵母細胞内の様々なオルガネラ膜区画に移植することを着想しました。PSはミトコンドリア外膜と内膜の間の領域(膜間部)に移動するとホスファチジルエタノールアミン(PE)と呼ばれる異なるリン脂質に変換される性質があるため,細胞内の様々な区画で合成されたPSがPEに変換されれば,PSの合成されたオルガネラ膜からミトコンドリア膜間部へのリン脂質輸送経路が存在すると考えられます。
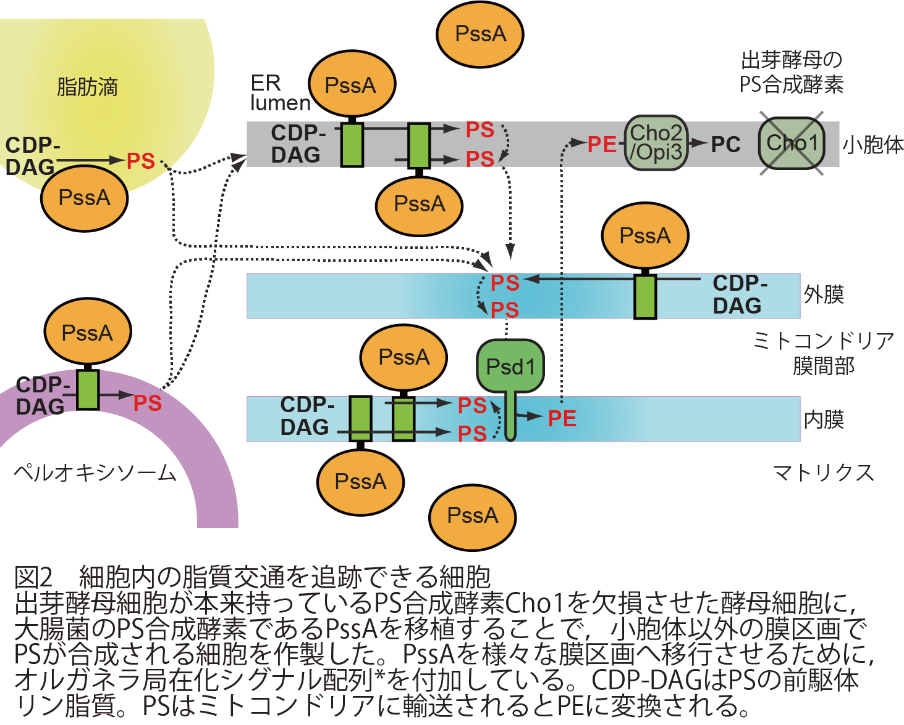
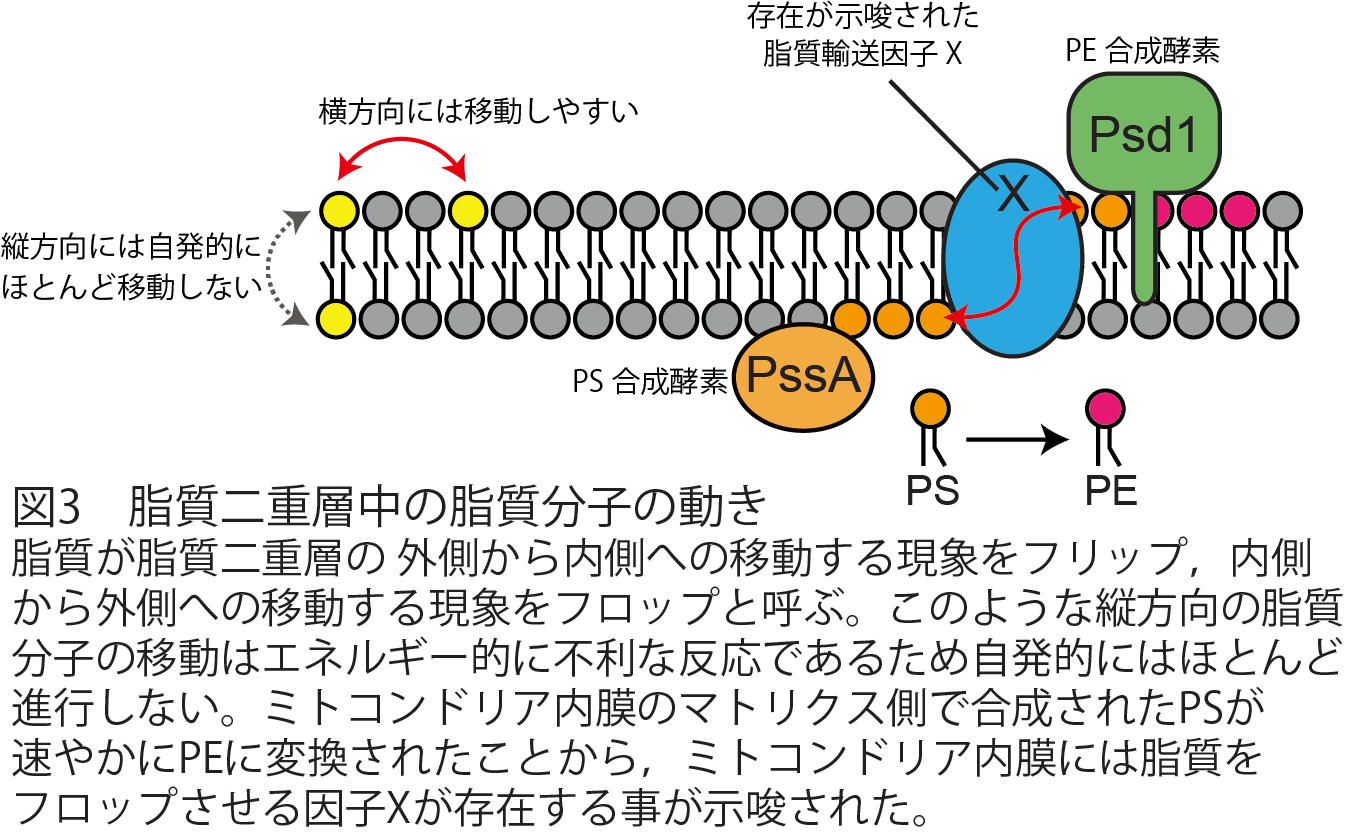
田村教授らの研究グループは,まず出芽酵母が本来持っているPS合成酵素Cho1を欠損させたCho1欠損細胞を作製しました。その細胞に,出芽酵母細胞内の様々なオルガネラ膜へ移行させるためのオルガネラ局在化シグナル配列を付加した大腸菌のPS合成酵素PssAを作らせることで,本来小胞体でのみ合成されていたPSが,ミトコンドリア外膜,内膜,マトリクス,ペルオキシソーム,脂肪滴といった様々なオルガネラ膜上で合成できるようにしました。PS合成酵素であるCho1が欠損した酵母細胞は強い増殖阻害を引き起こしますが,PSの本来の合成場所である小胞体に加えて,脂肪滴,ペルオキシソーム,ミトコンドリア内膜にPssAを移植した細胞では,その増殖が回復することがわかりました。さらにこれらの細胞内で合成されるPSを放射性同位体で標識し,その動態を解析したところ,脂肪滴,ペルオキシソームで合成されたPSが,効率よくPEに変換されることがわかりました。この結果は,ペルオキシソームや脂肪滴といったオルガネラ膜からミトコンドリアへ,効率よく脂質が移動する経路があることを示唆します。また興味深いことに,ミトコンドリアマトリクスと呼ばれるミトコンドリア内膜の内側の領域で合成されたPSも,PEへと変換されることがわかりました。この結果は,ミトコンドリア内膜のマトリクス側で合成されたPSがフロップして,ミトコンドリア膜間部に存在するPsd1と呼ばれるPE合成酵素(PS脱炭酸酵素)によって,PEに変換されたことを示しています。この実験系の確立により,これまで生きた細胞で計測することが難しかったミトコンドリア内膜におけるリン脂質のフロップ活性を,PS→PEの変換を指標に簡便に計測することが可能となりました。通常,脂質二重層における縦方向の脂質移動はエネルギー的に不利な反応であるため,自発的にはほとんど進行しないことが知られています。今回の実験結果は,ミトコンドリア内膜には未知の脂質輸送因子Xが存在することを示唆する重要な発見と言えます。
【今後の展望】
本研究によって,これまでに知られていなかった新しい細胞内脂質輸送経路の存在が明らかになりました。今後,これらの新しい経路において,直接脂質を輸送する因子や,輸送を調節する因子を解明することで,正常なオルガネラ膜が形成されるメカニズムの理解が進むものと考えられます。オルガネラの機能異常や,脂質の代謝異常によって様々な疾患が引き起こされることが知られています。細胞内の脂質輸送機構の基本原理を理解することで,これら疾患の病態解明や,治療開発に役立つことが期待されます。
【掲載雑誌】
雑誌名: FEBS Journal 著者: 椎野浩也1,古田詩唯奈1, 小島理恵子1, 遠藤斗志也2, 田村康1. 題名: Phosphatidylserine flux into mitochondria unveiled by organelle-targeted Escherichia coli phosphatidylserine synthase PssA 所属: 1. 山形大学理学部 2.京都産業大学総合生命科学部
【助成】
本研究は,AMED-Prime革新的先端研究開発支援事業 「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」(JP20gm5910026 研究代表:田村康), JSPS科研費 挑戦的研究(萌芽)「蛍光性非天然アミノリン脂質合成酵素の創出」(17K19338研究代表:田村康)の一環として行われました。