







ホーム > 研究 > 注目の研究 > 生物学 > 細胞の中にも社会基盤:細胞内の物流を理解する
掲載日:2018.06.05
准教授:田村康(分子細胞生物学)
生物がどのような仕組みで生きているのか?といった基礎的な問題には、まだ数多くの謎が残されています。その中の一つが細胞内における物流システムです。生物の構成単位である細胞の中を観察すると、そこには人間の社会とよく似た「細胞の社会」が広がっています。田村研究室では、細胞の社会における物流システムがどのように整備させているのか、また物流がどのように調節されているのかといった謎を解明するべく研究を進めています。最近、細胞の中に張り巡らされた脂質の交通網を研究する過程で、これまで独立に存在すると考えられてきた細胞小器官同士が、互いに一部結合することで脂質を輸送する道を作ることを見出しました。この発見は、細胞構造の概念を書き換える成果として注目されています。
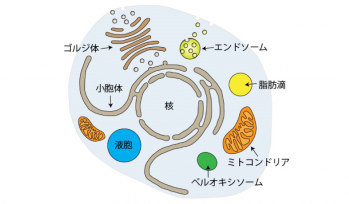 私たち人間の体は約37兆個の細胞から構成されると言われています。この細胞の中には脂質の膜で囲まれたオルガネラと呼ばれる構造が高度に発達しています。DNAを保存する核や、タンパク質の合成を行う小胞体、生きるために必須のエネルギーを生産するミトコンドリアや、形が異常になって不要になったタンパク質や脂質などを分解する液胞(リソソーム)などがその代表例です(右図)。これらの構造は、いわば細胞が生きるために整備された細胞の社会基盤であり、正常な細胞活動を行うためには必須のものです。これらのオルガネラの機能異常が、様々なヒトの疾患の原因となることがわかっています。
私たち人間の体は約37兆個の細胞から構成されると言われています。この細胞の中には脂質の膜で囲まれたオルガネラと呼ばれる構造が高度に発達しています。DNAを保存する核や、タンパク質の合成を行う小胞体、生きるために必須のエネルギーを生産するミトコンドリアや、形が異常になって不要になったタンパク質や脂質などを分解する液胞(リソソーム)などがその代表例です(右図)。これらの構造は、いわば細胞が生きるために整備された細胞の社会基盤であり、正常な細胞活動を行うためには必須のものです。これらのオルガネラの機能異常が、様々なヒトの疾患の原因となることがわかっています。
細胞の社会基盤を適切に維持するためには、人間社会と同じように、常にスクラップ・アンド・ビルドを繰り返さなければなりません。その際に必須となるのが、「必要なものを、必要な時に、必要なだけ、適切な場所へ輸送する細胞内の物流システム」です。例えばタンパク質の多くは細胞質と呼ばれるオルガネラの「外」で合成されるため、オルガネラの「内部」で機能するタンパク質は、合成された後に特定のオルガネラ内へと適切に輸送されなければなりません。実はタンパク質の細胞内輸送メカニズムに関しては昔から精力的に研究されており、多くのことが明らかになっています(1999年,2013年のノーベル生理学・医学賞はタンパク質輸送の研究者に対して贈られている)。
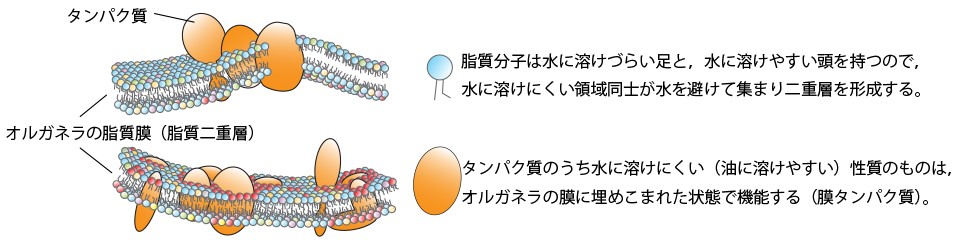
その一方で、脂質の細胞内交通の問題はこれまで長らく見過ごされてきました。これは脂質がタンパク質のように遺伝子操作によって改変できないことや、脂質が水に溶けにくく、実験的に扱いづらいことなどが、研究が進まなかった原因です。しかし細胞の社会基盤の主役は脂質膜(下図)で作られたオルガネラであるため、脂質の物流の問題は、細胞の社会を理解する上で欠かすことの出来ないトピックです。私たちは、この未開拓の分野に切り込み、これまで世界をリードする成果を上げ続けています。
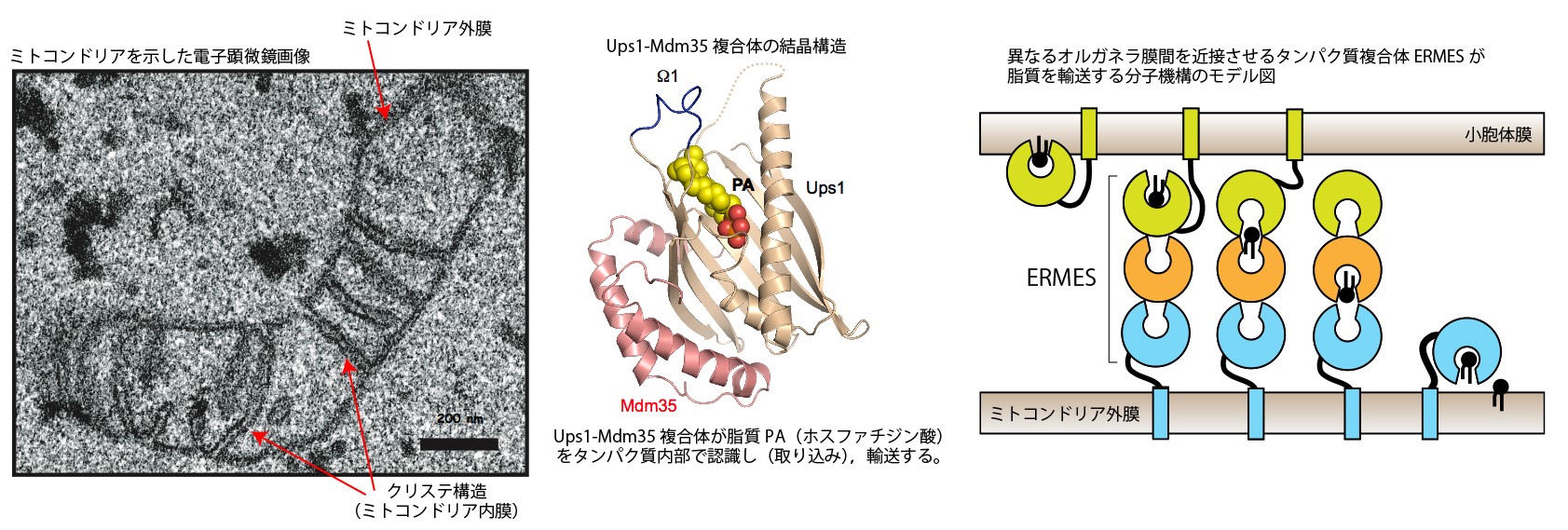
ミトコンドリアは外膜、内膜、2つの脂質膜で構成されるオルガネラですが、この2つの脂質膜間でどのように脂質が輸送されるのかは謎でした。ミトコンドリアの内膜はクリステ(下図、左)と呼ばれる特殊な構造を形成するため、ミトコンドリア外膜・内膜間の脂質輸送メカニズムは、クリステの形成メカニズムを理解する上でも重要になってきます。私たちはUps1-Mdm35と呼ばれるタンパク質複合体がミトコンドリア外膜から内膜へと脂質を輸送するタンパク質であることを発見しました(下図、中)。またERMESとよばれるタンパク質複合体が、ミトコンドリアと小胞体を直接結合させ、異なる膜間が近接した領域で脂質輸送を行う因子であることも見出しています(下図、右)。
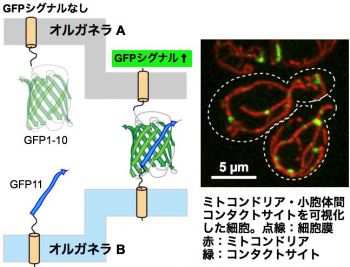 ERMESのような特殊なタンパク質複合体を使って膜間を近接させることで、水に溶けづらい脂質分子を輸送しやすくしていることが示唆されました。これまでオルガネラ同士は、その独自の機能を保つために独立に存在すると考えられてきたことから、オルガネラ間近接サイトの発見や、オルガネラ間近接サイト脂質輸送が行われているという発見は、これまでの常識を覆す非常にインパクトの大きいものでした。このような経緯から、細胞の中に他にもオルガネラコンタクトがあるのか、あるとすればどういった因子がオルガネラ間を結合しているのか、ということを明らかにしたいと考えました。オルガネラ間コンタクトを研究するためには、オルガネラ間コンタクトサイトを評価する実験が必要になります。試行錯誤の結果、私たちはsplit-GFPという蛍光タンパク質を2つに分断したタンパク質を用いて、異なるオルガネラ間コンタクトサイトの可視化に成功しました(右図)。Split-GFPは単独では蛍光を出すことが出来ませんが、2つのGFP断片の距離が十分に近づいたときのみGFP分子が再構成し、蛍光を出せるようになる分子です。オルガネラ間のコンタクトサイトの可視化技術によって、今後新しいオルガネラ間結合因子の発見や、オルガネラ間のコンタクトサイトの新しい機能の解明につながることが期待されます。
ERMESのような特殊なタンパク質複合体を使って膜間を近接させることで、水に溶けづらい脂質分子を輸送しやすくしていることが示唆されました。これまでオルガネラ同士は、その独自の機能を保つために独立に存在すると考えられてきたことから、オルガネラ間近接サイトの発見や、オルガネラ間近接サイト脂質輸送が行われているという発見は、これまでの常識を覆す非常にインパクトの大きいものでした。このような経緯から、細胞の中に他にもオルガネラコンタクトがあるのか、あるとすればどういった因子がオルガネラ間を結合しているのか、ということを明らかにしたいと考えました。オルガネラ間コンタクトを研究するためには、オルガネラ間コンタクトサイトを評価する実験が必要になります。試行錯誤の結果、私たちはsplit-GFPという蛍光タンパク質を2つに分断したタンパク質を用いて、異なるオルガネラ間コンタクトサイトの可視化に成功しました(右図)。Split-GFPは単独では蛍光を出すことが出来ませんが、2つのGFP断片の距離が十分に近づいたときのみGFP分子が再構成し、蛍光を出せるようになる分子です。オルガネラ間のコンタクトサイトの可視化技術によって、今後新しいオルガネラ間結合因子の発見や、オルガネラ間のコンタクトサイトの新しい機能の解明につながることが期待されます。